Var usikre på bruk av kontrollgruppe i Ebola-forsking
For å sikre eit robust forskingsresultat, fekk kontrollgruppa i Ebola-ramma Guinea forseinka vaksinering. – Vi var veldig i tvil om dette, seier Britt Ingjerd Nesheim i REK sør-øst.
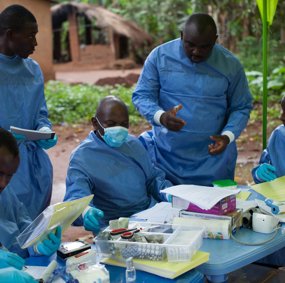
 Vaksineringa starta i april 2015. I den eine gruppa blei deltakarane vaksinert så snart dei var identifisert i kontaktringen – som regel landsbyen eller nabolaget – rundt ein smitta. I kontrollgruppa måtte deltakarane vente i 21 dagar. Inkubasjonstida for Ebola er på rundt 10 dagar.
Vaksineringa starta i april 2015. I den eine gruppa blei deltakarane vaksinert så snart dei var identifisert i kontaktringen – som regel landsbyen eller nabolaget – rundt ein smitta. I kontrollgruppa måtte deltakarane vente i 21 dagar. Inkubasjonstida for Ebola er på rundt 10 dagar.
Den internasjonale studien var delfinansiert med norske midlar og hadde norske medarbeidarar. På nyåret vurderte Regional komité for medisinsk og helsefaglig forskningsetikk, Sør-Øst Norge (REK sør-øst) studien.
Komiteen strevde med fråga om å nytte eit randomisert klinisk forsøk i ein slik situasjon. Randomisering tyder her at det skjedde ei tilfeldig fordeling av kontaktringar – enten til umiddelbar eller forseinka vaksinering.
– Dette var ein dødeleg sjukdom, og ei vaksine ein trudde var effektiv etter forsøk på dyr. Vi diskuterte veldig mykje om det var andre måtar å gjere dette på. For eit robust vitskapeleg svar er det viktig med randomiserte forsøk. Vi landa på at dette var forsvarleg, seier Nesheim, som leier komité C i REK sørøst.
For å forsvare eit slikt kontrollert forsøk, skal det normalt vere genuin uvisse om vaksinen har nytte. Her var det god grunn til å tru at deltakarane i gruppa som fekk vaksine med ein gong, hadde ein fordel.
Spenningsforhold
– Er det etisk forsvarleg å bryte med dette prinsippet i ein katastrofesituasjon? spør Jan Helge Solbakk, professor ved Senter for medisinsk etikk ved Universitetet i Oslo.
I medisinsk forsking er det ei spenning mellom plikta til å generere ny kunnskap for å betre førebygging, diagnostikk og behandling – og plikta til å vise omsyn til enkeltindividet sine interesser og velferd.
– I katastrofesituasjonar blir denne spenninga meir uttalt fordi tidsfaktoren er så uhyre mykje viktigare, seier Solbakk. Forskingsetikken har som kjerneprinsipp at omsynet til den enkelte skal kome framfor samfunnet og vitskapen. På den andre sida frykta ein katastrofale konsekvensar for samfunnet dersom ein ikkje raskt fekk til gode utprøvingar av vaksiner eller behandlingsmetodar.
Vitskapeleg robust
Klinisk utprøving av nye medikament er strengt regulert, og kontrollgrupper skal med for å sikre at ein faktisk måler verknaden av medikamentet, og ikkje effekten av andre forhold.
Sjølv i ein krisesituasjon der det hastar, kan ein ikkje fire på kravet om å generere vitskapeleg robuste svar.
– Ved svineinfluensa anbefalte norske styresmakter ein vaksine som ikkje var godt nok utprøvd til at vaksineprodusenten ville ta ansvar om det skulle oppstå biverknader, seier Solbakk.
Norsk pasientskadeerstatning har så langt betalt over 170 millionar kroner til meir enn 100 personar med alvorlige biverknader etter vaksinasjon i 2009 og 2010, og meir vil det bli.
– Ein må vere sikker på at kunnskapen ein genererer, er vitskapeleg valid, seier Solbakk.
REK sør-øst tvilte tvilte seg fram til at det var rett å randomisere i Guinea.
– Eg trur eg ville tvilt meg fram til det same. I røynda er det sjeldan mogeleg å finne heilt ideelle løysingar, seier Solbakk.
Hjelpearbeidarar slapp å vente
Alle lokale hjelpearbeidarar i Ebola-responsen fekk tilbod om vaksinen i ein parallell studie utan kontrollgruppe.
Dette skapte også diskusjon. REK sør-øst grunngjev godkjenninga av å gi alle hjelpearbeidarar vaksinen straks, med at styresmaktene i Guinea stilte det som krav.
– Om utprøvinga skulle bli gjennomført, måtte det bli på den måten, seier Britt Ingjerd Nesheim.
Argumentet var at dei i større grad er utsette for smitterisiko. Sjuke er avhengige av at dei kan halde fram med arbeidet sitt. Jan Helge Solbakk stiller seg tvilande til at dette fekk passere.
– Her blir to regime for regulering blanda saman. I ein reint klinisk samanheng bør hjelpearbeidarar ha prioritet. Då kjenner vi konsekvensane, og samfunnsinteressene kjem først – for eksempel gjennom plikta til å isolere sjuke for å skydde andre, seier han.
- Ein akseptert tenkemåte
I forsking veit vi ikkje om ei vaksine vil gi skydd, og omsynet til den enkelte skal difor kome framfor omsynet til samfunnet og vitskapen.
– I samband med forsking har vi kanskje godt funderte hypotesar, men vi forskar nettopp for å finne ut om dei stemmer. Difor er kravet om skydd av den enkelte sine interesser sterkare enn i ein klinisk samanheng, seier Solbakk.
Steinar Madsen i Legemiddelverket meiner det var rett å gjere utprøvinga på denne måten.
– Her ser eg ikkje dei store prinsipielle forskjellane mellom forsking og andre situasjonar som er meir avklarte, til dømes dersom Noreg skulle bli ramma av ein pandemi. Å verne nøkkelpersonell i krise er ein akseptert måte å tenke på, seier han.
Viste seg å vere effektiv
Dei første funna blei publiserte i juli 2015 og viste at vaksinen virka. Ingen blei sjuke blant dei som fikk vaksine med éin gong, medan 16 blei sjuke i kontrollgruppa som måtte vente.
Allereie etter mellombels analysar forsto forskarane at vaksinen gav skydd. Kontrollgruppa blei kutta ut, og vaksinen blei gitt til alle.
På dette tidspunktet hadde forskarane vaksinert 90 kontaktringar, mot planlagde 190. Sidan epidemien hadde ebba ut, ville det no ta lang tid å auke den vitskapelege presisjonen.
– Av etiske omsyn syntest vi ikkje at vi kunne halde fram med kontrollgruppa, seier John Arne Røttingen, smitteverndirektør i Folkehelseinstituttet. Han leia den internasjonale forskargruppa, og fortel at dei så langt ikkje har fått kritikk for å bruke ei kontrollert utprøving.
– Tvert imot. Vi har fått kritikk for å sløyfe kontrollgruppa for tidleg. Fleire meiner vi burde hatt kontrollgrupper med placebo – og ikkje forseinka vaksinering, seier Røttingen.
Om forskarane hadde valt å randomisere i ein annan ratio for raskt å kunne gi vaksina til fleire – for eksempel med dobbelt så mange til umiddelbar vaksinering som i kontrollgruppa, hadde dei ikkje fått ut eit signifikant svar. Kontrollgruppa ville blitt for lita.
Steinar Madsen, medisinsk fagdirektør i Legemiddelverket, meiner ein kan sette etiske standardar for høgt.
– Det er viktig at standardane er høge, men ikkje så høge at ein ikkje får undersøkt problemstillinga på ein praktisk overkomeleg måte, seier han.
Ulik behandling
Midt i sommarferien fekk REK sør-øst søknad om prosjektendringa for å sløyfe kontrollgruppa og inkludere born ned til 13 år i utprøvinga.
– Det var lenge til neste komitémøte. Å inkludere born er ein vanlegvis veldig forsiktig med, men her tok eg avgjersla åleine og sa ja på fullmakt same dag som vi mottok søknaden, fortel Nesheim.
Seinare har også born ned til seks år blitt inkludert. Utprøvinga held fram, og er utvida til Sierra Leone, som første veka i november blei erklært fri for Ebola.
Totalt har rundt 10 000 menneske blitt vaksinert.
– Det er ein del press på å få tilgjenge til vaksinen, fortel Røttingen.
Han trur den hjelpte styresmaktene i Guinea med å få kontroll på utbrotet.
– Vi har vaksinert kontaktringane i kring halvparten av alle nye tilfelle og brote mange smittekjedar tidleg, seier Røttingen.
Kva som skal skje etter at utprøvinga er avslutta, blir opp til legemiddelfirmaet Merck.
– Dei må summere opp kunnskapen og sende søknad om løyve til marknadsføring, seier Røttingen.